В серии клеточных исследований в Медицинском колледже Национального Тайваньского университета в Тайбэе ученые обнаружили, что трансмембранный фермент (белок, встроенный в клетку с активными частями выше и ниже поверхности клетки) играет важную роль в повреждении клеток печени. Этот фермент известен под названием гепсин и вырабатывается человеком. Он увеличивает уязвимость к раку печени, потому что становится перебежчиком, биологическим предателем в вирусной среде.
Главное исследование качалось вирусов гепатитов B и C.
Оказалось, что гепсин даже не взаимодействует с самими вирусами, чтобы нанести ущерб печени; он повреждает защитный белок STING. После того, как STING поврежден, вирусы могут беспрепятственно проходить через печень.
«Наше исследование дает новое понимание», - заявили доктора. Фу Синь и Хелен Миньи Лю, опубликовали результаты своего исследования в журнале Science Signaling . «Хронические вирусные инфекции печени могут привести к дисфункции органов и гепатоцеллюлярной карциноме.Трансмембранная сериновая протеаза гепсин подавляет индукцию интерферона типа I , расщепляя STING», - написали Син и Лю.
Тайваньское исследование показывае, что гепсин подавляет естественные противовирусные реакции организма, которые запускаются STING, стимулятор генов интерферона. Когда STING не поврежден, его сигнальная активность участвует в высвобождении огромного потока борющихся с вирусами интерферонов, белков, препятствующих вирусам.
Активация STING стимулирует экспрессию генов, кодирующих интерфероны I типа, как часть противовирусного ответа. Интерфероны типа I включают большую подгруппу белков, которые помогают регулировать активность иммунной системы. В дополнение к своей роли в активации интерферонов, которые контролируют вирусы, активация STING также играет важную роль в противоопухолевом иммунитете, что делает его критически важным для общего врожденного иммунного ответа.
Предполагается, что STING активируется на ранней стадии врожденного иммунного ответа, когда обнаруживаются вирусы и для полномасштабной атаки необходимы каскады молекулярных атак со стороны стимулированной иммунной системы.
Оказывается, перебежчик гепсин буквально рубит STING, тем самым отключая врожденный иммунный ответ. Компоненты иммунной системы, подрываемые гепсином, представляют собой интерфероны типа I, белки, которые не только убивают вирусы, но и имеют решающее значение для сигнальной активности, которая управляет дополнительными компонентами иммунной системы. Слово «предатель» кажется слишком добрым, если принять во внимание степень разрушения печени, которую непреднамеренно допускает гепсин.
«Гепсин, который преимущественно присутствует в гепатоцитах, ингибирует индукцию интерферона I типа во время вирусных инфекций», - говорят Синь и Лю, отмечая, что без интерферонов I типа вирусная инфекция может развиваться бесконтрольно.
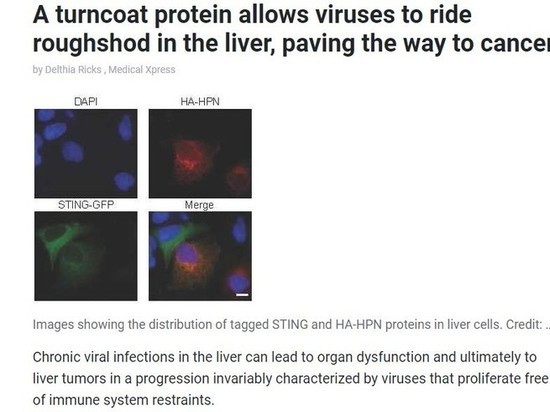
Тайваньская команда видела, как гепсин атакует STING в лаборатории, наблюдая за повреждением инфицированных эмбриональных фибробластов мыши и инфицированных гепатоцитов человека. «Гепсин локализовался вместе с STING в эндоплазматическом ретикулуме и расщепил STING», - утверждают ученые.
Гепсин также есть в других тканях, особенно в носоглотке, которая образует верхние дыхательные пути и нижние дыхательные пути, включая легкие. В этих тканях гепсин, известный как TMPRSS1, также существует в этих тканях как трансмембранный предатель.
В случае инфицирования коронавирусомTMPRSS1 посылает сигналы, которые могут предупредить вирус о присутствии рецептора ACE2. Рецептор ACE2 является ближайшим соседом TMPRSS1 и уязвимым шлюзом, который ковид прорывает, чтобы проникнуть в человеческие клетки, что приводит к иногда смертельному исходу. Среди исследователей нет сомнений в том, что передача сигналов TMPRSS1 помогает вирусу.
Чтобы было ясно, одна из основных ролей иммунной системы - предотвращать захват клеток вирусами. Но когда гепсин калечит STING, на фоне продолжающейся инфекции печени готовится почва для рака печени. Исследования не только открывают новое окно для понимания того, как может быть повреждена сигнальная молекула, но также демонстрируют, как крохотный трансмембранный фермент играет роль в возникновении разрушения.
Новое исследование проводится в критический момент, когда международные агентства здравоохранения, особенно Всемирная организация здравоохранения (ВОЗ), разрабатывают стратегии по снижению бремени болезней печени и рака печени. Во всем мире рак печени является ведущей формой смерти, связанной с раком, и основной причиной этих злокачественных новообразований является вирусная инфекция органа, преимущественно гепатитом B и C.
По оценкам ВОЗ, около 1,1 миллиона человек ежегодно умирают от рака печени, вызванного вирусными инфекциями. Несмотря на то, что вакцина, используемая с 1980-х годов, способна предотвратить заражение гепатитом B, а в последние годы лекарственная терапия эффективно лечит гепатит C, эти меры по-прежнему недоступны во многих частях мира. Понимание основных молекулярных механизмов, которые в первую очередь приводят к раку, может проложить путь к новым методам профилактики рака печени, таким как разработка фармацевтических стратегий, блокирующих гепсин, говорится в выводах работы исследователей.